A TEMPERATURA QUE ALTERA AS VIBRAÇÕES E OS FLUXOS DAS ENERGIAS, DIMENSÕES E FENÔMENOS TAMBÉM ALTERA OS SPINS, MOMENTUNS, MOMENTUNS MAGNÉTICOS, E OUTROS.
CONDE COM ISTO SE TEM NOVOS NÚMEROS QUÂNTICO DE GRACELI [TEMPERATURA, VIBRAÇÕES, E FLUXOS VARIACIONAIS.]
ONDE SE FORMA UMA NOVA FÍSICA QUÂNTICA, DE CONDUTIVIDADE, ELÉTRICA, MAGNÉTICA, ELETROMAGNÉTICA, MODELO PADRÃO, SIMETRIAS, DINÂMICAS, E MECÂNICAS.
COM AÇÃO E VARIAÇÕES SOBRE A QUÍMICA, A FÍSICA, RELATIVIDADES, E OUTROS.
OU SEJA, UM SISTEMA GENERALIZADO VARIACIONAL SOBRE TODAS AS FÍSICAS, QUÍMICAS,E BIOLOGIA MOLECULAR, E SUAS RAMIFICAÇÕES.
sexta-feira, 21 de agosto de 2020
CONFORME AUMENTA A TEMPERATURA, TAMBÉM APROXIMADAMENTE AUMENTA A DILATAÇÃO [CONFORME OS MATERIAIS DENTRO DO SISTEMA SDCTIE GRACELI] COM ISTO AUMENTA AS VIBRAÇÕES, SPINS, NÚMEROS QUÂNTICO DE GRACELI, ESTRUTURA ELETRÕNICA, E ESTADOS QUÂNTICO, COM ISTO SE TEM UM SISTEMA VARIACIONAL EM TODAS AS TEORIAS E PRINCÍPIOS, E FUNDAMENTOS ENVOLVENDO MODELO ATÕMICO, QUÍMICA QUÂNTICA, E TODA A MECÂNICA QUÂNTICA, COMO E ENTRE TANTAS TEORIAS COM A INCERTEZA, EXCLUSÃO, ÁTOMO DE BOHR E OUTROS, EQUAÇÕES DA PRIMEIRA E SEGUNDA TEORIA QUÂNTICA, COOMO TAMBÉM TODA TEORIA ENVOLVENDO A TERCEIRA TEORIA QUANTICA SDCTIE GRACELI.
OU SEJA, SE TEM UMA TEORIA E MECÂNICA QUÂNTICA VARIACIONAL CONFORME SE ENCONTRA EM ÍNDICES E TIPOS DE INTENSIDADES DE TEMPERATURA.
O MESMO ACONTECE PARA A ELETROSTÁTICA, ELETROMAGNETISMO, TEORIA DE PARTÍCULAS, GAUGE, SIMETRIAS, PARIDADES, MODELO PADRÃO TÉRMICO, E OUTROS.
VEJAMOS EM:
TERCEIRA QUANTIZAÇÃO PELO SDCTIE GRACELI
TRANS-QUÂNTICA SDCTIE GRACELI, TRANSCENDENTE, RELATIVISTA SDCTIE GRACELI, E TRANS-INDETERMINADA.
FUNDAMENTA-SE EM QUE TODA FORMA DE REALIDADE SE ENCONTRA EM TRANSFORMAÇÕES, INTERAÇÕES, TRANSIÇÕES DE ESTADOS [ESTADOS DE GRACELI], ENERGIAS E FENÔMENOS DENTRO DE UM SISTEMA DE DEZ OU MAIS DIMENSÕES DE GRACELI, E CATEGORIAS DE GRACELI.
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS =
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
x [EQUAÇÃO DE DIRAC].
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE RADIOATIVIDADE
, + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ ENTROPIA REVERSÍVEL
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
ENERGIA DE PLANCK
X
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......ΤDCG
XΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
sistema de dez dimensões de Graceli + DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..
- DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.
xsistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].x
número atômico, estrutura eletrônica, níveis de energia - TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
- T l T l E l Fl dfG l
X [ESTADO QUÂNTICO]
xtoda forma de função e equação em:
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......ΤDCG XΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli +DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..- DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.xsistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].x
- TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
- DT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLl
Transformação politrópica
Uma transformação politrópica é uma transformação termodinâmica na qual a pressão e o volume de um gás (normalmente considerado ideal) são relacionados por um expressão da forma:
a quantidade é a priori um número real arbitrário.
Uma transformação politrópica é uma transformação termodinâmica na qual a pressão e o volume de um gás (normalmente considerado ideal) são relacionados por um expressão da forma:
a quantidade é a priori um número real arbitrário.
Casos particulares
- Quando , a equação (1) reduz-se a:
neste caso, o pressão é mantida constante e o processo é dito isobárico.
- Quando , a equação (1) reduz-se a:
Se o gás é considerado ideal , a temperatura é mantida constante e o processo é dito isotérmico.
- Quando o gás é ideal e é a coeficiente de expansão adiabática, então (1) descreve um processo adiabático e isentrópico.
- Quando , a equação (1) assume a forma:
e o processo é isocórico.
- Quando , a equação (1) reduz-se a:
neste caso, o pressão é mantida constante e o processo é dito isobárico.
- Quando , a equação (1) reduz-se a:
Se o gás é considerado ideal , a temperatura é mantida constante e o processo é dito isotérmico.
- Quando o gás é ideal e é a coeficiente de expansão adiabática, então (1) descreve um processo adiabático e isentrópico.
- Quando , a equação (1) assume a forma:
e o processo é isocórico.
Fluido politrópico
Fluidos politrópicos são fluidos idealizados de especial importância na astrofísica e constituem um caso particular dos fluidos barotrópicos onde a equação de estado é dada por:
Aqui, n é chamado de índice do politropo.
Uma estrutura esférica formada por um gás cuja equação de estado é a dos fluidos politrópicos submetida à influência exclusiva do campo gravitacional de sua própria massa é chamada de politropo e o perfil de densidade e pressão em função da distância ao centro é dada pela equação de Lane-Emden.
Fluidos politrópicos são fluidos idealizados de especial importância na astrofísica e constituem um caso particular dos fluidos barotrópicos onde a equação de estado é dada por:
Aqui, n é chamado de índice do politropo.
Uma estrutura esférica formada por um gás cuja equação de estado é a dos fluidos politrópicos submetida à influência exclusiva do campo gravitacional de sua própria massa é chamada de politropo e o perfil de densidade e pressão em função da distância ao centro é dada pela equação de Lane-Emden.
Processo termodinâmico
Um sistema pode ser considerado isolado se ele não sofre ação de forças externas, com isso o sistema tende a se manter o mesmo, ou seja, continuar estável. Existem vários processos termodinâmicos que são facilmente visualizados, por exemplo os que tem uma função de estado constante. A definição para função de estado são as grandezas definem um estado termodinâmico, tais como pressão volume e temperatura. Definimos equilíbrio termodinâmico quando não mais acontecem mudanças na função de estado, ou seja, não há mais troca de calor. As principais possíveis mudanças que podem ocorrer são de três maneiras : mecânica, química e térmica. A primeira maneira é quando o meio ambiente exerce uma força sobre o sistema, essa força irá interferir seu estado de equilíbrio existente, por causa de uma perturbação mecânica. Essa força poderá fazer que o sistema diminua seu volume (como um êmbolo quando pressionado). Além disso, pode associar um aumento de pressão do gás, caso o sistema esteja em contato com um banho térmico e perca calor. Depois de retornar ao isolamento, e depois de algum tempo de relaxação, o sistema alcança um novo estado de equilíbrio mecânico. A segunda maneira é quando o sistema troca matéria com o meio que passa por ele, acontece uma perturbação química, e esse acontecimento pode gerar uma alteração na composição química do sistema. Após ele retornar ao isolamento, e depois de um tempo, acontecerá uma uniformização na composição do sistema e o mesmo alcançará um novo equilíbrio térmico. A terceira maneira é quando o sistema entra em contato térmico com corpos externos, com isso acontecerá um troca de calor, e o sistema sairá do equilíbrio térmico, depois de voltar para o isolamento, e depois eu um período de tempo o sistema encontrará um novo equilíbrio térmico. Quando o sistema entra em equilíbrio térmico em relação as três maneiras mencionadas dizemos que ele está em equilíbrio termodinâmico, com isso ele pode ser descrito pro função de estado, que são consideradas pro sistema todo. [1]
Uma grandeza termodinâmica, deve-se pensar em um gás composto por partículas em um recipiente, que pode apresentar modos diversos. Pode-se variar o volume do recipiente aumentando ou diminuindo a região disponível para as partículas de gás. Ainda precisa considerar que o recipiente é um material isolante, para impedir a troca de calor entre o gás e o recipiente. Agora sim pode colocar o recipiente em contato com um banho térmico, de modo a ceder ou absorver calor do gás, o banho térmico vai ceder ou absorver calor do gás, porem sua temperatura vai ser mantida constante. Por exemplo colocar um copo de água em um balde de gelo, ele absorvera o calor da água (resfriando-a) praticamente sem variar sua temperatura. A temperatura T, o volume V, e a pressão P do gás, são funções do estado. Então quando um sistema está em equilíbrio termodinâmico, as funções, P, V, T são bem definidas, e definem o estado em que o sistema se encontra. Se conhecemos duas dessas grandezas conseguimos definir a terceira. Para gases ideais a equação utilizada para encontrar a terceira grandeza é definida por:
,
onde n é o número de mols do gás e R é a constante universal dos gases.
Um processo termodinâmico é um evento caracterizado por variáveis de uma ou mais funções de estado. Se um sistema está em equilíbrio termodinâmico e sofre uma mudança bem pequena em algumas funções de estado, depois de um certo período de tempo ele consegue encontrar um novo equilíbrio, se deixado isolado, como novos valores nas funções de estado. Essa pequena mudança chama-se de processo quase estático. Para que qualquer processo seja reversível, precisa-se conhecer todas as micro-mudanças que ocorreram entre o estado iniciado e final. Essas mudanças que as grandezas sofrem em uma transformação são totalmente relacionados com a primeira lei a termodinâmica, que é definida pela equação:
,
Onde é denominada a energia interna do gás, Q é o calor absorvido pelo gás e W o trabalho executado pelo gás.
Um sistema pode ser considerado isolado se ele não sofre ação de forças externas, com isso o sistema tende a se manter o mesmo, ou seja, continuar estável. Existem vários processos termodinâmicos que são facilmente visualizados, por exemplo os que tem uma função de estado constante. A definição para função de estado são as grandezas definem um estado termodinâmico, tais como pressão volume e temperatura. Definimos equilíbrio termodinâmico quando não mais acontecem mudanças na função de estado, ou seja, não há mais troca de calor. As principais possíveis mudanças que podem ocorrer são de três maneiras : mecânica, química e térmica. A primeira maneira é quando o meio ambiente exerce uma força sobre o sistema, essa força irá interferir seu estado de equilíbrio existente, por causa de uma perturbação mecânica. Essa força poderá fazer que o sistema diminua seu volume (como um êmbolo quando pressionado). Além disso, pode associar um aumento de pressão do gás, caso o sistema esteja em contato com um banho térmico e perca calor. Depois de retornar ao isolamento, e depois de algum tempo de relaxação, o sistema alcança um novo estado de equilíbrio mecânico. A segunda maneira é quando o sistema troca matéria com o meio que passa por ele, acontece uma perturbação química, e esse acontecimento pode gerar uma alteração na composição química do sistema. Após ele retornar ao isolamento, e depois de um tempo, acontecerá uma uniformização na composição do sistema e o mesmo alcançará um novo equilíbrio térmico. A terceira maneira é quando o sistema entra em contato térmico com corpos externos, com isso acontecerá um troca de calor, e o sistema sairá do equilíbrio térmico, depois de voltar para o isolamento, e depois eu um período de tempo o sistema encontrará um novo equilíbrio térmico. Quando o sistema entra em equilíbrio térmico em relação as três maneiras mencionadas dizemos que ele está em equilíbrio termodinâmico, com isso ele pode ser descrito pro função de estado, que são consideradas pro sistema todo. [1]
Uma grandeza termodinâmica, deve-se pensar em um gás composto por partículas em um recipiente, que pode apresentar modos diversos. Pode-se variar o volume do recipiente aumentando ou diminuindo a região disponível para as partículas de gás. Ainda precisa considerar que o recipiente é um material isolante, para impedir a troca de calor entre o gás e o recipiente. Agora sim pode colocar o recipiente em contato com um banho térmico, de modo a ceder ou absorver calor do gás, o banho térmico vai ceder ou absorver calor do gás, porem sua temperatura vai ser mantida constante. Por exemplo colocar um copo de água em um balde de gelo, ele absorvera o calor da água (resfriando-a) praticamente sem variar sua temperatura. A temperatura T, o volume V, e a pressão P do gás, são funções do estado. Então quando um sistema está em equilíbrio termodinâmico, as funções, P, V, T são bem definidas, e definem o estado em que o sistema se encontra. Se conhecemos duas dessas grandezas conseguimos definir a terceira. Para gases ideais a equação utilizada para encontrar a terceira grandeza é definida por:
,
onde n é o número de mols do gás e R é a constante universal dos gases.
Um processo termodinâmico é um evento caracterizado por variáveis de uma ou mais funções de estado. Se um sistema está em equilíbrio termodinâmico e sofre uma mudança bem pequena em algumas funções de estado, depois de um certo período de tempo ele consegue encontrar um novo equilíbrio, se deixado isolado, como novos valores nas funções de estado. Essa pequena mudança chama-se de processo quase estático. Para que qualquer processo seja reversível, precisa-se conhecer todas as micro-mudanças que ocorreram entre o estado iniciado e final. Essas mudanças que as grandezas sofrem em uma transformação são totalmente relacionados com a primeira lei a termodinâmica, que é definida pela equação:
,
Onde é denominada a energia interna do gás, Q é o calor absorvido pelo gás e W o trabalho executado pelo gás.
Equação de Lane-Emden
Em astrofísica, a equação de Lane-Emden é uma equação diferencial ordinária que modeliza a estrutura interna de um sistema termodinâmico descrito pela equação de estado de um fluido politrópico auto-gravitante, ou seja, sujeito somente a influência de sua própria massa. A equação é obtida a partir da hipótese adicional de simetria esférica, que exclui as situações em que os sistemas possuem movimento de rotação.
Essa equação determina o perfil de pressão, densidade e temperatura em alguns casos de interesse físico, como o gás ideal e o gás degenerado de férmions à temperatura nula nas situações não-relativística e ultra-relativística. Esses modelos permitem uma descrição simples de anãs brancas e outros astros compactos, nos quais a pressão de degenerescência tem um papel importante.
A equação de Lane-Emden recebe o seu nome em homenagem aos astrofísicos Jonathan Lane e Robert Emden, sendo Lane quem primeiro propôs esta equação em 1870. Lord Kelvin e A. Ritter fizeram contribuições importantes ao estudo dessa equação no século XIX, assim como Ralph H. Fowler e Subrahmanyan Chandrasekhar nos anos 1930.
Em astrofísica, a equação de Lane-Emden é uma equação diferencial ordinária que modeliza a estrutura interna de um sistema termodinâmico descrito pela equação de estado de um fluido politrópico auto-gravitante, ou seja, sujeito somente a influência de sua própria massa. A equação é obtida a partir da hipótese adicional de simetria esférica, que exclui as situações em que os sistemas possuem movimento de rotação.
Essa equação determina o perfil de pressão, densidade e temperatura em alguns casos de interesse físico, como o gás ideal e o gás degenerado de férmions à temperatura nula nas situações não-relativística e ultra-relativística. Esses modelos permitem uma descrição simples de anãs brancas e outros astros compactos, nos quais a pressão de degenerescência tem um papel importante.
A equação de Lane-Emden recebe o seu nome em homenagem aos astrofísicos Jonathan Lane e Robert Emden, sendo Lane quem primeiro propôs esta equação em 1870. Lord Kelvin e A. Ritter fizeram contribuições importantes ao estudo dessa equação no século XIX, assim como Ralph H. Fowler e Subrahmanyan Chandrasekhar nos anos 1930.
Índice
Apresentação
A equação diferencial de Lane-Emden é dada por:
onde é o raio reescalonado:
e a densidade é dada como.
os subescritos "c" referem-se aos valores de referência da adimensionalização e são normalmente escolhidos os valores encontrados no centro do politropo. A condição de simetria esférica implica necessariamente que a derivada é nula em :
O valor de em , pode ser obtido a partir do valor da densidade:
- é dado
No caso mais comum em que escolhe-se , temos:
A equação diferencial de Lane-Emden é dada por:
onde é o raio reescalonado:
e a densidade é dada como.
os subescritos "c" referem-se aos valores de referência da adimensionalização e são normalmente escolhidos os valores encontrados no centro do politropo. A condição de simetria esférica implica necessariamente que a derivada é nula em :
O valor de em , pode ser obtido a partir do valor da densidade:
- é dado
No caso mais comum em que escolhe-se , temos:
Contexto físico
Em um fluido politrópico, a pressão P está relacionada com a densidade por uma equação de estado da forma:
- ,
onde C é uma constante e é um número não inferior a 1 chamado de constante adiabática. A constante adiabática se relaciona com índice do politropo pela relação:
- .
O fluido está submetido à força gerada pelo seu próprio campo gravitacional. Esta força é radial e aponta para o centro da estrutura. A magnitude da força gravitacional é denotada pela letra g é considerada uma função da distância ao centro r:
do teorema das cascas esféricas a força gravitacional dentro de uma estrutura com simetria esférica é dado pela expressão:
onde é massa total contida até a distância r do centro:
aqui é densidade do fluido à distância s do centro.
Como o fluido está em equilíbrio hidrostático, vale a equação de Poisson:
Em um fluido politrópico, a pressão P está relacionada com a densidade por uma equação de estado da forma:
- ,
onde C é uma constante e é um número não inferior a 1 chamado de constante adiabática. A constante adiabática se relaciona com índice do politropo pela relação:
- .
O fluido está submetido à força gerada pelo seu próprio campo gravitacional. Esta força é radial e aponta para o centro da estrutura. A magnitude da força gravitacional é denotada pela letra g é considerada uma função da distância ao centro r:
do teorema das cascas esféricas a força gravitacional dentro de uma estrutura com simetria esférica é dado pela expressão:
onde é massa total contida até a distância r do centro:
aqui é densidade do fluido à distância s do centro.
Como o fluido está em equilíbrio hidrostático, vale a equação de Poisson:
Tipos de processos
Processo termodinâmico
Um sistema pode ser considerado isolado se ele não sofre ação de forças externas, com isso o sistema tende a se manter o mesmo, ou seja, continuar estável. Existem vários processos termodinâmicos que são facilmente visualizados, por exemplo os que tem uma função de estado constante. A definição para função de estado são as grandezas definem um estado termodinâmico, tais como pressão volume e temperatura. Definimos equilíbrio termodinâmico quando não mais acontecem mudanças na função de estado, ou seja, não há mais troca de calor. As principais possíveis mudanças que podem ocorrer são de três maneiras : mecânica, química e térmica. A primeira maneira é quando o meio ambiente exerce uma força sobre o sistema, essa força irá interferir seu estado de equilíbrio existente, por causa de uma perturbação mecânica. Essa força poderá fazer que o sistema diminua seu volume (como um êmbolo quando pressionado). Além disso, pode associar um aumento de pressão do gás, caso o sistema esteja em contato com um banho térmico e perca calor. Depois de retornar ao isolamento, e depois de algum tempo de relaxação, o sistema alcança um novo estado de equilíbrio mecânico. A segunda maneira é quando o sistema troca matéria com o meio que passa por ele, acontece uma perturbação química, e esse acontecimento pode gerar uma alteração na composição química do sistema. Após ele retornar ao isolamento, e depois de um tempo, acontecerá uma uniformização na composição do sistema e o mesmo alcançará um novo equilíbrio térmico. A terceira maneira é quando o sistema entra em contato térmico com corpos externos, com isso acontecerá um troca de calor, e o sistema sairá do equilíbrio térmico, depois de voltar para o isolamento, e depois eu um período de tempo o sistema encontrará um novo equilíbrio térmico. Quando o sistema entra em equilíbrio térmico em relação as três maneiras mencionadas dizemos que ele está em equilíbrio termodinâmico, com isso ele pode ser descrito pro função de estado, que são consideradas pro sistema todo. [1]
Uma grandeza termodinâmica, deve-se pensar em um gás composto por partículas em um recipiente, que pode apresentar modos diversos. Pode-se variar o volume do recipiente aumentando ou diminuindo a região disponível para as partículas de gás. Ainda precisa considerar que o recipiente é um material isolante, para impedir a troca de calor entre o gás e o recipiente. Agora sim pode colocar o recipiente em contato com um banho térmico, de modo a ceder ou absorver calor do gás, o banho térmico vai ceder ou absorver calor do gás, porem sua temperatura vai ser mantida constante. Por exemplo colocar um copo de água em um balde de gelo, ele absorvera o calor da água (resfriando-a) praticamente sem variar sua temperatura. A temperatura T, o volume V, e a pressão P do gás, são funções do estado. Então quando um sistema está em equilíbrio termodinâmico, as funções, P, V, T são bem definidas, e definem o estado em que o sistema se encontra. Se conhecemos duas dessas grandezas conseguimos definir a terceira. Para gases ideais a equação utilizada para encontrar a terceira grandeza é definida por:
,
onde n é o número de mols do gás e R é a constante universal dos gases.
Um processo termodinâmico é um evento caracterizado por variáveis de uma ou mais funções de estado. Se um sistema está em equilíbrio termodinâmico e sofre uma mudança bem pequena em algumas funções de estado, depois de um certo período de tempo ele consegue encontrar um novo equilíbrio, se deixado isolado, como novos valores nas funções de estado. Essa pequena mudança chama-se de processo quase estático. Para que qualquer processo seja reversível, precisa-se conhecer todas as micro-mudanças que ocorreram entre o estado iniciado e final. Essas mudanças que as grandezas sofrem em uma transformação são totalmente relacionados com a primeira lei a termodinâmica, que é definida pela equação:
,
Onde é denominada a energia interna do gás, Q é o calor absorvido pelo gás e W o trabalho executado pelo gás.
Um sistema pode ser considerado isolado se ele não sofre ação de forças externas, com isso o sistema tende a se manter o mesmo, ou seja, continuar estável. Existem vários processos termodinâmicos que são facilmente visualizados, por exemplo os que tem uma função de estado constante. A definição para função de estado são as grandezas definem um estado termodinâmico, tais como pressão volume e temperatura. Definimos equilíbrio termodinâmico quando não mais acontecem mudanças na função de estado, ou seja, não há mais troca de calor. As principais possíveis mudanças que podem ocorrer são de três maneiras : mecânica, química e térmica. A primeira maneira é quando o meio ambiente exerce uma força sobre o sistema, essa força irá interferir seu estado de equilíbrio existente, por causa de uma perturbação mecânica. Essa força poderá fazer que o sistema diminua seu volume (como um êmbolo quando pressionado). Além disso, pode associar um aumento de pressão do gás, caso o sistema esteja em contato com um banho térmico e perca calor. Depois de retornar ao isolamento, e depois de algum tempo de relaxação, o sistema alcança um novo estado de equilíbrio mecânico. A segunda maneira é quando o sistema troca matéria com o meio que passa por ele, acontece uma perturbação química, e esse acontecimento pode gerar uma alteração na composição química do sistema. Após ele retornar ao isolamento, e depois de um tempo, acontecerá uma uniformização na composição do sistema e o mesmo alcançará um novo equilíbrio térmico. A terceira maneira é quando o sistema entra em contato térmico com corpos externos, com isso acontecerá um troca de calor, e o sistema sairá do equilíbrio térmico, depois de voltar para o isolamento, e depois eu um período de tempo o sistema encontrará um novo equilíbrio térmico. Quando o sistema entra em equilíbrio térmico em relação as três maneiras mencionadas dizemos que ele está em equilíbrio termodinâmico, com isso ele pode ser descrito pro função de estado, que são consideradas pro sistema todo. [1]
Uma grandeza termodinâmica, deve-se pensar em um gás composto por partículas em um recipiente, que pode apresentar modos diversos. Pode-se variar o volume do recipiente aumentando ou diminuindo a região disponível para as partículas de gás. Ainda precisa considerar que o recipiente é um material isolante, para impedir a troca de calor entre o gás e o recipiente. Agora sim pode colocar o recipiente em contato com um banho térmico, de modo a ceder ou absorver calor do gás, o banho térmico vai ceder ou absorver calor do gás, porem sua temperatura vai ser mantida constante. Por exemplo colocar um copo de água em um balde de gelo, ele absorvera o calor da água (resfriando-a) praticamente sem variar sua temperatura. A temperatura T, o volume V, e a pressão P do gás, são funções do estado. Então quando um sistema está em equilíbrio termodinâmico, as funções, P, V, T são bem definidas, e definem o estado em que o sistema se encontra. Se conhecemos duas dessas grandezas conseguimos definir a terceira. Para gases ideais a equação utilizada para encontrar a terceira grandeza é definida por:
,
onde n é o número de mols do gás e R é a constante universal dos gases.
Um processo termodinâmico é um evento caracterizado por variáveis de uma ou mais funções de estado. Se um sistema está em equilíbrio termodinâmico e sofre uma mudança bem pequena em algumas funções de estado, depois de um certo período de tempo ele consegue encontrar um novo equilíbrio, se deixado isolado, como novos valores nas funções de estado. Essa pequena mudança chama-se de processo quase estático. Para que qualquer processo seja reversível, precisa-se conhecer todas as micro-mudanças que ocorreram entre o estado iniciado e final. Essas mudanças que as grandezas sofrem em uma transformação são totalmente relacionados com a primeira lei a termodinâmica, que é definida pela equação:
,
Onde é denominada a energia interna do gás, Q é o calor absorvido pelo gás e W o trabalho executado pelo gás.
Processo cíclico
Um processo cíclico equivale a um processo repetitivo de transferências que têm, muitas vezes, como estados finais o próprio estado inicial. O ciclo ao se encerrar ele retorna ao início do processo. Este é um tipo de processo que em algumas substâncias plásticas não há sua utilização, por seu trabalho sofrer mudanças irreversíveis. Um processo cíclico de um sistema requer a sua envolvente, pelo menos, dois reservatórios de calor, a temperaturas diferentes, um a uma temperatura mais elevada, que fornece calor para o sistema, o outro a uma temperatura mais baixa que aceita o calor do sistema. Os valores de pressão, volume e temperatura são idênticos aos do inicio do processo, sendo ao final da transformação continua o mesmo estado termodinâmico. Uma consequência é o fato da variação da energia interna ser nula ao final do ciclo. Se as temperaturas inicial e final são iguais, a mesma acontece com a energia interna. O trabalho total em um ciclo será a soma dos trabalhos de cada transformação. Assim, trabalhos positivos nas expansões e trabalhos negativos nas contrações. Um ciclo no sentido horário, o módulo dos trabalhos durante as expansões é maior do que os módulos dos trabalhos nas contrações, resultando um trabalho positivo, que pode ser calculado através da área do ciclo. Ao contrario um ciclo no sentido anti-horário, o módulo dos trabalhos durante as contrações é maior do que os módulos dos trabalhos nas contrações, resultando um trabalho positivo, que pode ser calculado através da área do ciclo.
Um processo cíclico equivale a um processo repetitivo de transferências que têm, muitas vezes, como estados finais o próprio estado inicial. O ciclo ao se encerrar ele retorna ao início do processo. Este é um tipo de processo que em algumas substâncias plásticas não há sua utilização, por seu trabalho sofrer mudanças irreversíveis. Um processo cíclico de um sistema requer a sua envolvente, pelo menos, dois reservatórios de calor, a temperaturas diferentes, um a uma temperatura mais elevada, que fornece calor para o sistema, o outro a uma temperatura mais baixa que aceita o calor do sistema. Os valores de pressão, volume e temperatura são idênticos aos do inicio do processo, sendo ao final da transformação continua o mesmo estado termodinâmico. Uma consequência é o fato da variação da energia interna ser nula ao final do ciclo. Se as temperaturas inicial e final são iguais, a mesma acontece com a energia interna. O trabalho total em um ciclo será a soma dos trabalhos de cada transformação. Assim, trabalhos positivos nas expansões e trabalhos negativos nas contrações. Um ciclo no sentido horário, o módulo dos trabalhos durante as expansões é maior do que os módulos dos trabalhos nas contrações, resultando um trabalho positivo, que pode ser calculado através da área do ciclo. Ao contrario um ciclo no sentido anti-horário, o módulo dos trabalhos durante as contrações é maior do que os módulos dos trabalhos nas contrações, resultando um trabalho positivo, que pode ser calculado através da área do ciclo.
Processo de fluxo
Um processo de fluxo delimitado nos limites de um sistema aberto controla o volume presente em um sistema. Durante o funcionamento de um processo, o fluxo do processo deve considerar estável e contínuo, a matéria fluindo de dentro-fora e fora-dentro deve ser quimicamente homogênea. Não há fluxo se o sistema flui com uma taxa uniforme, sem variação de calor e trabalho, esse não fluxo caso eficaz, equivale ao processo de fluxo. Supõe-se que a energia potencial gravitacional e a energia cinética do fluxo, com as entradas e saídas de calor e trabalho são rígidas e imóveis. Muitas vezes, as quantidades que descrevem os estados internos dos materiais de entrada e saída são estimadas na suposição de que eles são corpos em seus próprios estados de equilíbrio termodinâmico interno. Como as reações rápidas são permitidas, o tratamento termodinâmico pode ser aproximado, não exato. No funcionamento de algum dispositivo com este processo, no sistema o volume é controlado independente do tempo, ou seja, a energia interna do sistema pelo volume permanece constante, útil para geração de energia.
Um processo de fluxo delimitado nos limites de um sistema aberto controla o volume presente em um sistema. Durante o funcionamento de um processo, o fluxo do processo deve considerar estável e contínuo, a matéria fluindo de dentro-fora e fora-dentro deve ser quimicamente homogênea. Não há fluxo se o sistema flui com uma taxa uniforme, sem variação de calor e trabalho, esse não fluxo caso eficaz, equivale ao processo de fluxo. Supõe-se que a energia potencial gravitacional e a energia cinética do fluxo, com as entradas e saídas de calor e trabalho são rígidas e imóveis. Muitas vezes, as quantidades que descrevem os estados internos dos materiais de entrada e saída são estimadas na suposição de que eles são corpos em seus próprios estados de equilíbrio termodinâmico interno. Como as reações rápidas são permitidas, o tratamento termodinâmico pode ser aproximado, não exato. No funcionamento de algum dispositivo com este processo, no sistema o volume é controlado independente do tempo, ou seja, a energia interna do sistema pelo volume permanece constante, útil para geração de energia.
Processos variáveis
Pressão e volume
Pressão e volume estão relacionados com a transferência de energia mecânica ou dinâmica como resultado do trabalho.
Pressão e volume estão relacionados com a transferência de energia mecânica ou dinâmica como resultado do trabalho.
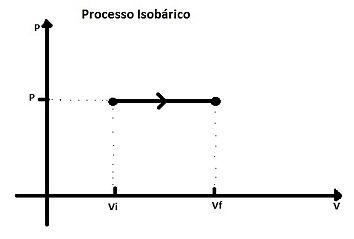
Processo isobárico
A transformação isobárica é um processo em que a pressão se mantém constante, como processos que ocorrem à pressão atmosférica. Podemos relacionar essa pressão (P), com a temperatura (T) e o volume (V), de acordo com a Lei dos gases ideais:
Onde n é o número de mols e R é a constante universal dos gases, com seu valor de 8,314 J mol-1K-1 ou 0,082 atm.L/mol.K
Podemos isolar a pressão (P), já que possui um valor constante, encontrando:
Como a pressão permanece fixa, seus valores inicial e final são iguais temos:
Cancelando o número de mols (n) e a constante (R), encontramos a equação para uma transformação isobárica:
De forma que, o volume (V) e a temperatura (T) são diretamente proporcionais.
No processo isobárico a Primeira lei da termodinâmica é dada por:
Onde o trabalho realizado sobre o gás é dado por:
Como a pressão é constante, não é integrada, e o novo trabalho (W) é:
Caso o trabalho (W) estiver com o sinal positivo indica que o trabalho é realizado pelo gás ao invés de ser realizado sobre o gás, como no nosso caso.
O calor (Q) de uma transformação isobárica é dada por:
Onde Cp é o calor especifico molar a uma pressão constante. Quando alguma energia é adicionada a um gás pelo calor de um processo isobárico, a energia interna do gás aumenta e é realizado trabalho (negativo) sobre o gás devido a variação de volume necessário para manter a mesma pressão.[1]
A transformação isobárica é um processo em que a pressão se mantém constante, como processos que ocorrem à pressão atmosférica. Podemos relacionar essa pressão (P), com a temperatura (T) e o volume (V), de acordo com a Lei dos gases ideais:
Onde n é o número de mols e R é a constante universal dos gases, com seu valor de 8,314 J mol-1K-1 ou 0,082 atm.L/mol.K
Podemos isolar a pressão (P), já que possui um valor constante, encontrando:
Como a pressão permanece fixa, seus valores inicial e final são iguais temos:
Cancelando o número de mols (n) e a constante (R), encontramos a equação para uma transformação isobárica:
De forma que, o volume (V) e a temperatura (T) são diretamente proporcionais.
No processo isobárico a Primeira lei da termodinâmica é dada por:
Onde o trabalho realizado sobre o gás é dado por:
Como a pressão é constante, não é integrada, e o novo trabalho (W) é:
Caso o trabalho (W) estiver com o sinal positivo indica que o trabalho é realizado pelo gás ao invés de ser realizado sobre o gás, como no nosso caso.
O calor (Q) de uma transformação isobárica é dada por:
Onde Cp é o calor especifico molar a uma pressão constante. Quando alguma energia é adicionada a um gás pelo calor de um processo isobárico, a energia interna do gás aumenta e é realizado trabalho (negativo) sobre o gás devido a variação de volume necessário para manter a mesma pressão.[1]
Processo isovolumétrico ou isocórico
A transformação isovolumétrica pode também ser chamada de transformação isocórica, na qual está relacionado ao comportamento dos gases, onde o volume é constante submetendo variações proporcionais de pressão e temperatura como mostrado abaixo.
A equação acima é dos gases ideais onde P representa pressão, V é volume, n é numero de mols, R é a constante de que equivale a 8,314 Jmol-1K-1, e T é a temperatura. Lembrando que a temperatura deve ser sempre absoluta, sendo em Kelvin (transformação de Celsius para Kelvin: TK = TC + 273,15).
Como o volume é constante pode-se igualar as funções com as temperaturas e pressões iniciais e finais, excluindo o numero de mols e a constante R.
Da equação acima, conclui-se por fim:
A transformação isovolumétrica também é conhecida como a 2ª Lei de Gay-Lussac, em homenagem ao físico-químico Joseph Louis Gay-Lussac que por volta de 1808 começou a estudar as propriedades e comportamentos dos gases.No processo isovolumétrico como o volume é constante não há trabalho, sendo considerado zero, portanto a equação da Primeira lei da termodinâmica se reduz à ∆Eint = Q onde Q é a energia transferida (calor) e ∆Eint é a variação da energia interna. O calor quando o volume de um gás é fixo é dada pela equação:
Onde n é o numero de mols, Cv o calor específico molar e ∆T é a variação de temperatura. Quando Q é positivo o sistema recebe calor, quando Q é negativo o sistema fornece calor. Se a energia é acrescentada por calor a um sistema mantido a volume constante, toda a energia transferida permanece no sistema como um aumento de sua energia interna, um exemplo muito usado é o da lata de spray, se colocado em contato com calor, mesmo com a lata vazia ainda assim contem ar ou resíduos do produto, a pressão aumenta podendo causar uma explosão.
A transformação isovolumétrica pode também ser chamada de transformação isocórica, na qual está relacionado ao comportamento dos gases, onde o volume é constante submetendo variações proporcionais de pressão e temperatura como mostrado abaixo.
A equação acima é dos gases ideais onde P representa pressão, V é volume, n é numero de mols, R é a constante de que equivale a 8,314 Jmol-1K-1, e T é a temperatura. Lembrando que a temperatura deve ser sempre absoluta, sendo em Kelvin (transformação de Celsius para Kelvin: TK = TC + 273,15).
Como o volume é constante pode-se igualar as funções com as temperaturas e pressões iniciais e finais, excluindo o numero de mols e a constante R.
Da equação acima, conclui-se por fim:
A transformação isovolumétrica também é conhecida como a 2ª Lei de Gay-Lussac, em homenagem ao físico-químico Joseph Louis Gay-Lussac que por volta de 1808 começou a estudar as propriedades e comportamentos dos gases.No processo isovolumétrico como o volume é constante não há trabalho, sendo considerado zero, portanto a equação da Primeira lei da termodinâmica se reduz à ∆Eint = Q onde Q é a energia transferida (calor) e ∆Eint é a variação da energia interna. O calor quando o volume de um gás é fixo é dada pela equação:
Onde n é o numero de mols, Cv o calor específico molar e ∆T é a variação de temperatura. Quando Q é positivo o sistema recebe calor, quando Q é negativo o sistema fornece calor. Se a energia é acrescentada por calor a um sistema mantido a volume constante, toda a energia transferida permanece no sistema como um aumento de sua energia interna, um exemplo muito usado é o da lata de spray, se colocado em contato com calor, mesmo com a lata vazia ainda assim contem ar ou resíduos do produto, a pressão aumenta podendo causar uma explosão.
Temperatura
Temperatura está relacionado com a transferência de energia, especialmente para um sistema fechado.
Temperatura está relacionado com a transferência de energia, especialmente para um sistema fechado.
Processo isotérmico
A palavra isotérmica refere-se a um processo em que tem-se a mesma temperatura, por isso, na Transformação isotérmica de um gás, a temperatura no início é a mesma que no final. Há uma variação de pressão e volume no processo isotérmico e, para um gás ideal, como a temperatura não se altera não há variação de energia interna no sistema, pois esta depende diretamente da temperatura. Para relacionar a pressão (P), temperatura (T) e volume (V) em uma transformação isotérmica para um gás ideal é levada em consideração a Lei de Boyle-Mariotte:
Em que n é o número de mols contido no volume e R é a constante universal dos gases, expressa por 8,314 J mol-1K-1 ou 0,082 atm.L/mol.K.
Isolando T, já que é constante, obtêm-se:
No processo, sabe-se que a pressão (Pi, Pf) e o volume (Vi, Vf) variam, portanto:
Cancelando as constantes n e R, obtêm-se a equação para uma transformação isotérmica:
Em um processo isotérmico há troca de energia em forma de calor e de trabalho.
Quando se mantém a temperatura T de um gás constante e altera-se seu volume de Vi para Vf obtêm-se um processo chamado expansão isotérmica – e seu inverso chamado de compressão isotérmica.
O trabalho de uma expansão isotérmica é determinado por:
Essa expressão pode ser utilizada para determinar o trabalho de qualquer gás em expansão isotérmica. Quando se trata de um gás ideal, a expressão será a seguinte:
Como T é uma constante (expansão isotérmica), assim como n e R, é retirado da integral, obtendo:
Levando em consideração as regras logarítmicas [ln a – ln b = ln (a/b)]:
Lembrando que só pode ser considerada essa fórmula para um gás ideal em processo isotérmico.
Como trata-se de uma expansão, Vf será sempre maior que Vi, por isso, a razão entre elas será maior que 1, e logaritmo natural de um número maior que 1 é sempre positivo. Portanto, o trabalho (W) realizado por um gás ideal em uma expansão isotérmica é sempre positivo. Para uma compressão (Vf menor que Vi) o trabalho (W), nas mesmas condições, será negativo. Usando a Primeira lei da termodinâmica para gases ideais, sabe-se que:
Em que ΔU é a variação da energia interna do gás, Q é o calor trocado entre os corpos do sistema e W é o trabalho realizado sobre o corpo. Sabe-se também que , (C é a capacidade térmica do corpo e ΔT a variação da temperatura). Como a variação de temperatura ΔT é nula (processo isotérmico) tem-se ΔU=0, portanto:
Ou seja, em um processo isotérmico, a quantidade de calor trocada entre os corpos é numericamente igual ao trabalho negativo.[2]
A palavra isotérmica refere-se a um processo em que tem-se a mesma temperatura, por isso, na Transformação isotérmica de um gás, a temperatura no início é a mesma que no final. Há uma variação de pressão e volume no processo isotérmico e, para um gás ideal, como a temperatura não se altera não há variação de energia interna no sistema, pois esta depende diretamente da temperatura. Para relacionar a pressão (P), temperatura (T) e volume (V) em uma transformação isotérmica para um gás ideal é levada em consideração a Lei de Boyle-Mariotte:
Em que n é o número de mols contido no volume e R é a constante universal dos gases, expressa por 8,314 J mol-1K-1 ou 0,082 atm.L/mol.K.
Isolando T, já que é constante, obtêm-se:
No processo, sabe-se que a pressão (Pi, Pf) e o volume (Vi, Vf) variam, portanto:
Cancelando as constantes n e R, obtêm-se a equação para uma transformação isotérmica:
Em um processo isotérmico há troca de energia em forma de calor e de trabalho.
Quando se mantém a temperatura T de um gás constante e altera-se seu volume de Vi para Vf obtêm-se um processo chamado expansão isotérmica – e seu inverso chamado de compressão isotérmica.
O trabalho de uma expansão isotérmica é determinado por:
Essa expressão pode ser utilizada para determinar o trabalho de qualquer gás em expansão isotérmica. Quando se trata de um gás ideal, a expressão será a seguinte:
Como T é uma constante (expansão isotérmica), assim como n e R, é retirado da integral, obtendo:
Levando em consideração as regras logarítmicas [ln a – ln b = ln (a/b)]:
Lembrando que só pode ser considerada essa fórmula para um gás ideal em processo isotérmico.
Como trata-se de uma expansão, Vf será sempre maior que Vi, por isso, a razão entre elas será maior que 1, e logaritmo natural de um número maior que 1 é sempre positivo. Portanto, o trabalho (W) realizado por um gás ideal em uma expansão isotérmica é sempre positivo. Para uma compressão (Vf menor que Vi) o trabalho (W), nas mesmas condições, será negativo. Usando a Primeira lei da termodinâmica para gases ideais, sabe-se que:
Em que ΔU é a variação da energia interna do gás, Q é o calor trocado entre os corpos do sistema e W é o trabalho realizado sobre o corpo. Sabe-se também que , (C é a capacidade térmica do corpo e ΔT a variação da temperatura). Como a variação de temperatura ΔT é nula (processo isotérmico) tem-se ΔU=0, portanto:
Ou seja, em um processo isotérmico, a quantidade de calor trocada entre os corpos é numericamente igual ao trabalho negativo.[2]
Processo adiabático
Transformação adiabática é aquela transformação em que não há troca de energia com o meio externo (porém ocorre variação térmica), ela ocorre quando há uma expansão ou contração muito rápida de um gás. Todas as variáveis são alteradas no processo adiabático (P,V,T). Quando um gás é comprimido adiabaticamente (diminuição do volume), o trabalho é realizado por um agente externo. Com isso a energia do sistema aumenta até se igualar ao trabalho realizado, e como o sistema não realiza troca de energia com o meio, a temperatura aumenta como consequência. Na expansão adiabática (aumento do volume), o sistema utiliza parte de sua energia para realizar trabalho. Isso acarreta na diminuição da energia interna e consequentemente na diminuição da temperatura.
A energia interna U se transforma em trabalho diretamente. Porém Q= 0 pois o sistema não realiza troca de calor com o meio. Então:
No caso de o gás ser monoatômico (um átomo), o trabalho realizado se dá por:
Já para um gás diatômico (dois átomos), o trabalho se dá por:
A equação de um gás em um processo adiabático é dada por:
Relação entre P e V
Onde, P é igual a pressão e V é o volume.
= razão entre os calores específicos
Quando o gás sofre alteração entre seu estado final e inicial, podemos escrever a equação de outra maneira:
Também podemos escrever a mesma equação em termos de pressão e temperatura, relembrando que:
Portanto:
Relação entre T e V
Quando o gás sofre alteração entre seu estado final e inicial, podemos escrever a equação de outra maneira:
Transformação adiabática é aquela transformação em que não há troca de energia com o meio externo (porém ocorre variação térmica), ela ocorre quando há uma expansão ou contração muito rápida de um gás. Todas as variáveis são alteradas no processo adiabático (P,V,T). Quando um gás é comprimido adiabaticamente (diminuição do volume), o trabalho é realizado por um agente externo. Com isso a energia do sistema aumenta até se igualar ao trabalho realizado, e como o sistema não realiza troca de energia com o meio, a temperatura aumenta como consequência. Na expansão adiabática (aumento do volume), o sistema utiliza parte de sua energia para realizar trabalho. Isso acarreta na diminuição da energia interna e consequentemente na diminuição da temperatura.
A energia interna U se transforma em trabalho diretamente. Porém Q= 0 pois o sistema não realiza troca de calor com o meio. Então:
No caso de o gás ser monoatômico (um átomo), o trabalho realizado se dá por:
Já para um gás diatômico (dois átomos), o trabalho se dá por:
A equação de um gás em um processo adiabático é dada por:
Relação entre P e V
Onde, P é igual a pressão e V é o volume.
= razão entre os calores específicos
Quando o gás sofre alteração entre seu estado final e inicial, podemos escrever a equação de outra maneira:
Também podemos escrever a mesma equação em termos de pressão e temperatura, relembrando que:
Portanto:
Relação entre T e V
Quando o gás sofre alteração entre seu estado final e inicial, podemos escrever a equação de outra maneira:
Processo isentrópico
Esse processo é habitualmente definido como adiabático quase-estático, de transferência de energia como trabalho. Caso contrário, para um processo de entropia constante, se o trabalho é feito irreversivelmente, a transferência de calor é necessária, de modo que o processo não é adiabático e é necessário um mecanismo de controle artificial preciso, ou seja, não é um processo termodinâmico natural ordinário.
O rendimento da máquina de Carnot é o máximo que uma máquina térmica trabalhando entre dadas temperaturas da fonte quente e da fonte fria pode ter (Mas o rendimento nunca chega a 100%). O rendimento da máquina em percentagem é igual a:
Onde:
- = Temperatura da fonte fria(em Kelvin)
- = Temperatura da fonte quente (em Kelvin)
A utilidade da máquina de Carnot é descobrir se uma máquina térmica tem bom rendimento, para assim ver se seu custo é viável para a indústria.
A possibilidade de interconversão entre calor e trabalho possui restrições para as máquinas térmicas. O Segundo Princípio da Termodinâmica, elaborado em 1824 por Sadi Carnot, é enunciado da seguinte forma:
" Para haver conversão contínua de calor em trabalho, um sistema deve realizar ciclos entre fontes quentes e frias, continuamente. Em cada ciclo, é retirada uma certa quantidade de calor da fonte quente (energia útil), que é parcialmente convertida em trabalho, sendo o restante rejeitado para a fonte fria (energia dissipada)"
Esse processo é habitualmente definido como adiabático quase-estático, de transferência de energia como trabalho. Caso contrário, para um processo de entropia constante, se o trabalho é feito irreversivelmente, a transferência de calor é necessária, de modo que o processo não é adiabático e é necessário um mecanismo de controle artificial preciso, ou seja, não é um processo termodinâmico natural ordinário.
O rendimento da máquina de Carnot é o máximo que uma máquina térmica trabalhando entre dadas temperaturas da fonte quente e da fonte fria pode ter (Mas o rendimento nunca chega a 100%). O rendimento da máquina em percentagem é igual a:
Onde:
- = Temperatura da fonte fria(em Kelvin)
- = Temperatura da fonte quente (em Kelvin)
A utilidade da máquina de Carnot é descobrir se uma máquina térmica tem bom rendimento, para assim ver se seu custo é viável para a indústria.
A possibilidade de interconversão entre calor e trabalho possui restrições para as máquinas térmicas. O Segundo Princípio da Termodinâmica, elaborado em 1824 por Sadi Carnot, é enunciado da seguinte forma:
" Para haver conversão contínua de calor em trabalho, um sistema deve realizar ciclos entre fontes quentes e frias, continuamente. Em cada ciclo, é retirada uma certa quantidade de calor da fonte quente (energia útil), que é parcialmente convertida em trabalho, sendo o restante rejeitado para a fonte fria (energia dissipada)"
 [EQUAÇÃO DE DIRAC].
[EQUAÇÃO DE DIRAC].
 + FUNÇÃO DE RADIOATIVIDADE
+ FUNÇÃO DE RADIOATIVIDADE
 + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ FUNÇÃO DE TUNELAMENTO QUÂNTICO. + ENTROPIA REVERSÍVEL
+ ENTROPIA REVERSÍVEL ![\sigma =q(n\mu _{n}+p\mu _{p})[\Omega .cm]^{{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53d1173dd9d9ec55715f1f4beb1ea5dcd4932bc8) FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA ENERGIA DE PLANCK
ENERGIA DE PLANCK

 [ESTADO QUÂNTICO]
[ESTADO QUÂNTICO]























































![{\displaystyle W=n\times R\times T\int _{Vi}^{Vf}{dV \over V}=n\times R\times T[\ln(Vf-Vi)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e283d8bf43459c5cbca0898a351a766e0079f744)



















Comentários
Postar um comentário